好房網News記者李佳慧/台北報導
生華科近年躍升為國際生醫圈高度關注的研發標的,關鍵在於公司同時推進兩項具突破性的創新藥物,分別從不同生物機制切入癌症免疫治療最難解的核心問題。CX-4945與CX-5461被視為互補的研發主軸,一者負責打開免疫辨識之門,另一者建立免疫記憶基礎,共同構築可長期延伸的免疫組合藥物架構。CX-4945為臨床開發中極為罕見的CK2抑制劑,CX-5461則是全球進度最領先的G-quadruplex穩定劑,兩項藥物皆已展現明確臨床潛力。
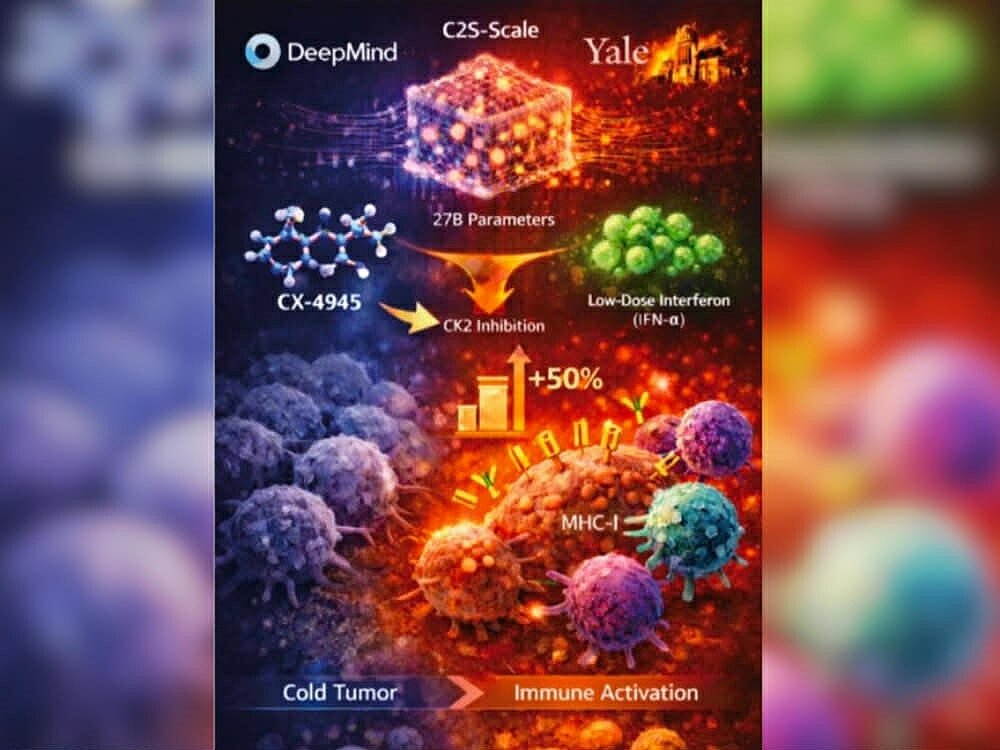
2024年諾貝爾化學獎頒發給Google DeepMind AI團隊成員Demis Hassabis與John Jumper,肯定其以AlphaFold2成功預測蛋白質結構,為藥物設計與免疫治療開啟全新方法論。隔年,Google DeepMind AI模型與耶魯大學臨床研究團隊首次共同驗證CX-4945的免疫應用潛力,證實其在腫瘤免疫調控上的關鍵角色,使生華科成為少數獲AI與臨床雙重背書的生技公司之一,相關成果迅速引發國際醫界與藥廠高度關注。

DeepMind的AI模型自超過4,000種藥物中篩選出CX-4945,指出其可選擇性強化腫瘤抗原呈現,並改善免疫系統對腫瘤的辨識能力,使原本免疫無法進入的冷腫瘤,轉化為可被攻擊的熱腫瘤。模型預測結果與體外實驗高度一致,顯示CX-4945具備成為AI世代免疫檢查點抑制劑組合「骨幹藥物」的潛力,也加速生華科與國際藥廠的授權與合作洽談,未來三年具備明確價值釋放空間。
在DeepMind與耶魯的合作研究中,研究團隊運用高達270億參數的單細胞分析模型,預測CX-4945抑制CK2後,能有效提升MHC-I表現。臨床前驗證顯示,腫瘤細胞合併CX-4945與低劑量干擾素治療時,抗原呈現能力可提升約五成,有助突破冷腫瘤長期難以被免疫系統辨識的結構性限制,為後續免疫療法創造必要條件。
CX-4945目前是全球唯一進入臨床二期開發階段的CK2抑制劑,兼具免疫調控與DNA複製調節等多重作用,並可靈活搭配化療或免疫治療策略。臨床上已在膽管癌與皮膚癌觀察到正向趨勢,並進一步拓展至多項高難度的兒童腫瘤試驗,累積Phase I/II安全性與初步療效數據,顯示其在全球藥物開發版圖中的稀缺性與戰略價值。
另一核心藥物CX-5461,則從DNA層級啟動免疫反應機制。生華科醫務長黃品諺指出,CX-5461具備低骨髓毒性的關鍵優勢,能在殺傷腫瘤的同時,保留免疫細胞存活並建立長期記憶,是免疫療法能否走向長期緩解的核心要素。該藥為全球首個取得美國FDA孤兒藥與Fast Track資格的G-quadruplex穩定劑,並被美國國家癌症研究院納入四項重點支持的開發計畫。
CX-5461可在腫瘤凋亡過程中釋放新抗原,活化樹突細胞並訓練T細胞精準辨識癌細胞,進而建立可持續巡邏的免疫記憶。目前已與多家國際藥廠展開免疫組合療法試驗,並切入免疫腫瘤治療核心應用,為PD-1抗藥患者提供新的治療選項與臨床解方。
在精準醫療布局方面,生華科亦攜手CancerFree Biotech導入「腫瘤分身平台」,透過少量血液即可培養患者專屬腫瘤模型,協助篩選對CX-4945與CX-5461最具反應潛力的族群,不僅加速臨床試驗進程,也有效提高成功率,進一步強化公司在全球市場的競爭力。
展望2026年後,生華科將陸續迎來多項關鍵臨床數據與國際授權里程碑。公司目標不僅止於延長存活期,而是透過免疫記憶的建立,讓治療效果真正留在患者體內。在全球腫瘤免疫治療高速成長的兆元市場中,生華科正以AI驗證機制、精準臨床策略與國際合作網絡,穩步卡位最具長期價值的關鍵環節。





